ANALYSE-SYSTEM FÜR DIE BRUSTKREBSDIAGNOSE ENTWICKELT
Wissenschaftler*innen der TU Berlin und der Charité – Universitätsmedizin Berlin sowie der Universität Oslo haben ein neues Analyse-System für die Brustkrebsdiagnostik anhand von Gewebeschnitten entwickelt, das auf Künstlicher Intelligenz (KI) beruht. Zwei Weiterentwicklungen machen das System einzigartig: Zum einen integriert es erstmals morphologische, molekulare und histologische Daten in einer Auswertung. Zum zweiten liefert es eine Erklärung des KI-Entscheidungsprozesses in Form von sogenannten Heatmaps mit. Diese Heatmaps zeigen Pixel für Pixel welche Bildinformation wie stark zu dem KI-Entscheidungsprozess beigetragen hat. Dadurch können die Mediziner*innen das Ergebnis der KI-Analyse nachvollziehen und auf Plausibilität prüfen. Künstliche Intelligenz wird damit erklärbar – ein entscheidender und unabdingbarer Schritt nach vorn, will man KI-Systeme künftig im Klinik-Alltag zur Unterstützung der Medizin einsetzen. Die Forschungsergebnisse wurden jetzt in Nature Machine Intelligence veröffentlicht.
Krebsmedizin beschäftigt sich zunehmend mit der molekularen Charakterisierung von Tumorgewebeproben. Ermittelt wird dabei unter anderem ob und/oder wie die DNA in dem Tumorgewebe sich verändert hat, die Genexpression oder auch die Protein-Expression in den Gewebeproben. Gleichzeitig setzt sich die Erkenntnis durch, dass die Krebsprogression eng mit der interzellulären Verbindung und der Interaktion der Krebszellen mit dem umgebenden Gewebe – einschließlich des Immunsystems – zusammenhängt.
Bilddaten liefern hohe räumliche Auflösung
Während mikroskopische Techniken die Untersuchung biologischer Prozesse mit hoher räumlicher Auflösung erlauben, können molekulare Marker mikroskopisch nur begrenzt erhoben werden. Sie werden vielmehr anhand von aus Gewebeproben extrahierter Proteine oder DNA ermittelt. Als Folge erlauben sie meist keine räumliche Auflösung und daher ist ihr Zusammenhang mit den mikroskopischen Strukturen typischerweise unklar. „Bei Brustkrebs ist bekannt, dass die Zahl eingewanderter Immunzellen, der sogenannten Lymphozyten, im Tumorgewebe einen Einfluss auf die Prognose der Patientin hat. Zusätzlich wird diskutiert, ob diese Zahl auch einen prädiktiven Wert hat – also Aussagen darüber ermöglicht, wie gut welche Therapie anschlägt“, so Prof. Dr. Frederick Klauschen vom Institut für Pathologie an der Charité.
„Das Problem: Wir haben gute und belastbare molekulare Daten und gute, räumlich hochaufgelöste histologische Daten. Aber es fehlte bislang die entscheidende Brücke zwischen den Bildgebungsdaten und den hochdimensionalen molekularen Daten“, ergänzt Prof. Dr. Klaus-Robert Müller, Professor für Maschinelles Lernen an der TU Berlin. Die beiden Wissenschaftler kooperieren bereits seit mehreren Jahren unter dem Dach des nationalen KI-Kompetenzzentrums Berlin Institute for the Foundations of Learning and Data (BIFOLD), das an der TU Berlin beheimatet ist.
Verbindungsstück zwischen molekularen und histologischen Daten fehlte
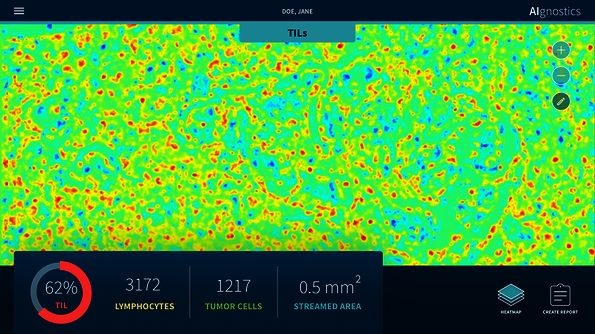
In dem jetzt veröffentlichten Ansatz gelang genau diese Symbiose. „Unser System ermöglicht die robuste Erkennung von pathologischen Veränderungen in mikroskopischen Bildern. Parallel dazu liefern wir eine präzise Heatmap-Visualisierung, die zeigt, welcher Pixel auf dem mikroskopischen Bild, in welchem Maße zu der Diagnose des Algorithmus beigetragen hat“, erläutert Klaus-Robert Müller. Zusätzlich haben die Wissenschaftler*innen das Verfahren noch einen großen Schritt weiterentwickelt: „Unser Analyse-System wurde mit Hilfe von maschinellen Lernverfahren so trainiert, dass es auch verschiedene molekulare Merkmale, wie zum Beispiel den Zustand der DNA, die Genexpression, oder auch die Protein-Expression in bestimmten Bereichen des Gewebes aus den histologischen Bildern vorhersagen kann.“
Als nächstes stehen die Zertifizierung und weitere klinische Validierungen – inklusive Tests in der Tumor-Routinediagnostik – auf der Agenda. Doch Frederick Klauschen ist überzeugt: „Die von uns entwickelte Methode erlaubt es in Zukunft, die histopathologische Tumordiagnostik präziser, standardisierter und damit auch qualitativ besser zu machen.“
PUBLIKATION:
Morphological and molecular breast cancer profiling through explainable machine learning, Nature Machine Intelligence
WEITERE INFORMATIONEN ERHALTEN SIE VON:
Prof. Dr. Klaus-Robert Müller
TU Berlin
Maschinelles Lernen
Tel.: 030 314 78621
E-Mail: klaus-robert.mueller@tu-berlin.de
Prof. Dr. Frederick Klauschen
Charité – Universitätsmedizin Berlin
Institut für Pathologie
Tel.: 030 450 536 053
E-Mail: frederick.klauschen@charite.de


